未承認の治験機器を用いて治験をする際に、自ら治験機器ラベルを作成する必要があります。
ラベル作成に必要とする項目を確認しておきます。
治験機器ラベルの作成をする前に確認しておきたいこと
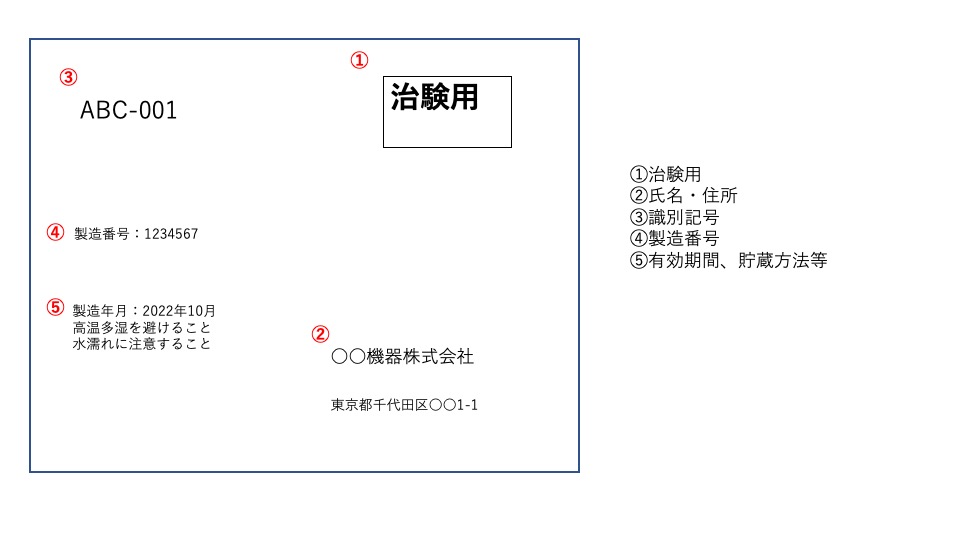
治験機器ラベルには、下記の項目が必須になります。
- 治験用である旨
- 治験依頼者の氏名及び住所(国内に住所がない場合は、本国での氏名・国名並びに治験国内管理人の氏名・住所)
- 原材料名又は識別記号
- 製造番号又は製造記号
- 貯蔵方法、有効期間等を定める必要があるものは、その内容
以下に例を挙げます。
特定臨床研究における試験機器ラベルの作成について
臨床研究法では、試験機器ラベルの詳細については触れていません。
代わりに、臨床研究に用いる医薬品等の品質確保に関する通知に記載があります。
承認・未承認に応じてラベルに記載する内容が違っています。
医薬品等の包装・表示に関する事項
ここでは、国内・海外ともに未承認である医薬品等を用いる場合として取り上げます。
臨床研究に用いる、医薬品や医療機器等の包装・表示については、以下を記載する必要があります。
- 医薬品等の名称
- 製造番号又は製造記号
- 医薬品等の管理に係る事項(保管方法など)
治験の場合とは若干違いがあるため、注意したいところです。
ISO14155におけるラベル表示
EU圏内で臨床試験を実施する場合は、ISO14155に則ってラベル表示を作成する必要があります。
表示に関する詳細な情報については、ISO15223-1、各国又は地域の法規定を参照することになります。
※ISO15223-1:2021 医療機器のラベル、ラベリング及び提供する情報に用いる記号についての要求事項を規定
被験機器、使用説明書または包装には、要求されない限り、当該被験機器は治験にのみ使用されることを明記しなければならない。
ISO14155 6.10 表示
まとめ
治験、臨床研究法、ISO14155における、包装へのラベル表示についてまとめました。
